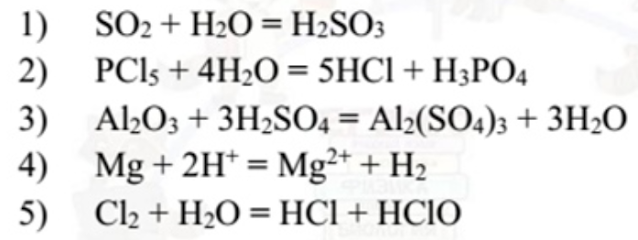Кинетика концентрации кислоты
Дарья почему-то засомневалась, что правильно решила эту задачу из сборника ЕГЭ. Поэтому прислала ее репетитору для проверки. Давайте систематизируем ход решения и не будем в дальнейшем сомневаться, как правильно делать и не пугаться немного необычных формулировок. Сразу говорю, Дарья решила правильно.
В каком случае уменьшение концентрации кислоты уменьшает скорость реакции (следует понимать, что прямой реакции, а не обратной).
НАЧИНАЕМ ВЫЯСНЯТЬ ПРАВДУ
Можно и переформулировать условие. Если уменьшение концентрации уменьшает скорость реакции, то увеличение концентрации аналогично увеличивает скорость реакции. Нас просто путают составители условия задачи, а разницы никакой нет.
Скорость реакции - это та скорость, с которой реагенты переходят в продукты. На эту скорость влияет температура (смотреть правило Вант-Гоффа) и концентрации реагентов. Больше ничего на скорость реакции не влияет, в том числе и концентрация продуктов. Важно не путать задание ЕГЭ на равновесие с кинетикой (там, где говорят про скорость).
Пройдемся по вариантам. В первом случае кислота - продукт. Ее концентрация влияет на состояние химического равновесия, но не на скорость. Во втором варианте сразу две кислоты, и обе - продукты. Тоже не годится.
А вот третий и четвертый варианты нам нравятся. Кислоты - реагенты. Уменьшишь их концентрацию - реакция станет медленнее. Увеличишь - побежит быстрее.
Наконец, пятый вариант аналогичен первым двум. Кислоты-продукты никакого влияния на скорость прямой реакции не оказывают. А вот на скорость обратной - всенепременно.
Ярлыки: егэ, кинетика, равновесие, химия